Η χρήση κυτταρικών θεραπειών για την θεραπεία του καρκίνου είναι ένας ταχέως αναπτυσσόμενος και ελπιδοφόρος νέος κλάδος στον τομέα της ανοσοθεραπείας. Οι θεραπείες αυτές γενικά ορίζονται ως παράγοντες που μπορούν να χρησιμοποιηθούν για την παραγωγή ανοσοανταπόκρισης έναντι στοχευμένων κυττάρων όγκου και περιλαμβάνουν φυσικά κύτταρα φονιάδες, κυτταροτοξικά Τ-λεμφοκύτταρα, ρυθμιστικά Τ κύτταρα, δενδριτικά κύτταρα και τροποποιημένους υποδοχείς Τ κυττάρων.
Τα Τ-κύτταρα χιμαιρικών υποδοχέων αντιγόνου (CAR-Τ) περιγράφονται ως ζωντανό φάρμακο: η χρήση γενετικώς τροποποιημένων Τ- κυττάρων, πολλαπλασιασμένων ex νίνο, για να παραχθεί ένα αντικαρκινικό φάρμακο. Σε αντίθεση με πολλές ογκολογικές θεραπείες, αυτά τα κύτταρα σχεδιάζονται για να στοχεύουν ένα μόνο αντιγόνο επιφάνειας, με αποτέλεσμα μια αξιοσημείωτη αποτελεσματικότητα στην εξάλειψη της κακοήθειας. Η αποτελεσματικότητα των Τ-κυττάρων εξαρτάται από την αλληλεπίδραση μεταξύ του CAR- Τ κυττάρου και αυτού του εκπεφρασμένου στόχου, επιτρέποντας στο CAR- Τ κύτταρο να δεσμεύεται και να εκκινεί μια ανοσοαπόκριση προς την υποκείμενη κακοήθεια.
Δύο παράγοντες που κατευθύνονται προς την CD19, μια πρωτεΐνη που συνήθως υπερεκφράζεται σε πολλές κακοήθειες των κυττάρων Β, έλαβαν έγκριση από την Αμερικανική Υπηρεσία Τροφίμων και Φαρμάκων (FDA) για τη θεραπεία της οξείας λεμφοβλαστικής λευχαιμίας (ALL) και του διάχυτου λεμφώματος μεγάλων κυττάρων Β (DLBCL). Διεξάγονται επιπλέον μελέτες για τη διερεύνηση της χρήσης CAR- Τ κυττάρων και άλλων κυττάρων ανοσοποιητικού παράγοντα που κατευθύνονται σε κακοήθειες αιματολογίας και συμπαγούς όγκου, με την αύξηση των προϊόντων και των ενδείξεων που προβλέπονται για έγκριση. Αυτό το άρθρο παρουσιάζει μια επισκόπηση με βάση την τεκμηρίωση της τρέχουσας κατάστασης της επιστήμης, συμπεριλαμβανομένης της παθοφυσιολογίας της θεραπείας των CAR -Τ κυττάρων, των σημερινών και πιθανών μελλοντικών ενδείξεων και των επιπτώσεων στην νοσηλευτική πρακτική.
Παθοφυσιολογία
Η προϋπόθεση για τη θεραπεία CAR -Τ κυττάρων έγκειται στις αλληλεπιδράσεις μεταξύ των υποδοχέων στην επιφάνεια των υγειών Τ- κυττάρων και των συνδιεγερτικών προσδεμάτων στην επιφάνεια του κυττάρου παρουσίασης αντιγόνου ή του όγκου. Το συν-διεγερτικό σήμα από τον όγκο χρησιμεύει ως διακόπτης ενεργοποίησης ή απενεργοποίησης στην έμφυτη απόκριση κυττάρων Τ του σώματος. Οι υποδοχείς των Τ-κυττάρων χρησιμεύουν είτε για την ενεργοποίηση είτε για την αναστολή αυτής της ανοσολογικής απόκρισης, και τα καρκινικά κύτταρα είναι εγγενώς σχεδιασμένα για να ξεπεράσουν την ανοσολογική απόκριση του οργανισμού ώστε να πολλαπλασιαστούν. Τα κύτταρα CAR- Τ αποτελούνται από τρεις ενότητες, την εξωκυτταρική σύνδεση στόχου, τη διαμεμβράνη και τον τομέα ενδοκυτταρικής σηματοδότησης. Αυτές οι ενότητες λειτουργούν ως γέφυρα, εκφράζοντας στοχοθετημένους υποδοχείς που αυξάνουν τη δέσμευση σε συγκεκριμένους τύπους καρκινικών κυττάρων και περαιτέρω απελευθερώνοντας το αντικαρκινικό αποτέλεσμα των Τ- κυττάρων τα οποία είναι ειδικά προγραμματισμένα να εμπλέκονται με αυτά τα συγκεκριμένα καρκινικά κύτταρα.
(γραφική αναπαράσταση αυτής της διαδικασίας)
Έχουν παραχθεί αρκετές γενιές CAR-Τ κυττάρων, αναζητώντας τους ιδανικούς τομείς σηματοδότησης για να στοχεύσουν να επιφέρουν το μέγιστο αντικαρκινικό αποτέλεσμα. Τα πρώιμα CAR-Τ κύτταρα βασίζονταν σε προσδέματα και στόχευαν ένα μόνο τομέα σηματοδότησης επικεντρωμένο στην αλυσίδα CD3z. Τα CARs δεύτερης γενιάς έχουν επεκταθεί για να επικεντρωθούν σε συν-διεγερτικά πεδία χρησιμοποιώντας μεταβλητή θραύσματος μονής αλυσίδας με έμφαση στο πρόσδεμα CD28 ή 4-1ΒΒ. Η μεταβλητή θραύσματος μονής αλυσίδας χρησιμεύει ως σύνδεσμος, επιτρέποντας στο CAR να δεσμεύεται στο στοχευόμενο επιφανειακό αντιγόνο του κυττάρου όγκου για να ξεκινήσει η ανοσοαπόκριση. Τα CARs τρίτης και τέταρτης γενιάς εξετάζονται για να εκτιμηθεί ο τρόπος αλληλεπίδρασης των επιπρόσθετων σημείων σηματοδότησης για την παραγωγή ενισχυμένου αντικαρκινικού αποτελέσματος ειδικά για την ασθένεια.
Τελευταία Νέα
Το Tisagenlecleucel (Kymriah®) έλαβε την αρχική έγκριση από το FDA το 2017 για τη θεραπεία ασθενών ηλικίας 25 ετών ή νεότερων με ανθεκτική ή υποτροπιάζουσα B-cell precursor ALL. Ακολούθησε έγκριση του το 2018 για θεραπεία ενηλίκων ασθενών με υποτροπιάζον ή ανθεκτικό DLBCL μετά από δύο ή περισσότερες γραμμές συστηματικής θεραπείας. Στα τέλη του 2017, χορηγήθηκε έγκριση τύπου FDA για το axilabtagene ciloleucel (Yescarta®) για τη θεραπεία ενηλίκων ασθενών με υποτροπιάζον ή ανθεκτικό DLBCL μετά από δύο ή περισσότερες γραμμές συστηματικής θεραπείας. Το Tisagenlecleucel και το ciloleucel axialabtagene είναι CD19-κατευθυνόμενα προϊόντα αυτόλογων Τ-κυττάρων. Το CD19 είναι το αντιγόνο που εκφράζεται στην επιφάνεια των Β κυττάρων και εκφράζεται υπερβολικά σε κακοήθη Β κύτταρα. Η κύρια διαφορά στα προϊόντα είναι ο τομέας συν-διεγέρσεως που χρησιμοποιείται για την ενίσχυση της επέκτασης. Το Tisagenlecleucel χρησιμοποιεί τον συνδέτη 4-1ΒΒ, ενώ το axicabtagene ciloleucel χρησιμοποιεί την πρωτεΐνη CD28. Και οι δύο συνδιεγερτικοί τομείς δρουν σε συνδυασμό με την πρωτεΐνη CD3z για την ενεργοποίηση των CAR T κυττάρων. Επιπρόσθετες δοκιμές που χρησιμοποιούν αυτά τα CD19-κατευθυνόμενα προϊόντα για άλλες κακοήθειες Β-κυττάρων βρίσκονται επίσης σε εξέλιξη
Ένα προϊόν που αναπτύχθηκε από την Celgene (σε συνεργασία με τη Bluebird Bio) για το πολλαπλό μυέλωμα, μια ασθένεια χωρίς γνωστές θεραπευτικές θεραπείες, αναμένεται να είναι το επόμενο προϊόν CAR T-cell που έχει εγκριθεί από την FDA. Αυτό το προϊόν στοχεύει αντιγόνο ωρίμανσης Β-κυττάρων, το οποίο εκφράζεται στην επιφάνεια των κυττάρων πλάσματος.
Πως παράγονται τα CAR-T κύτταρα;
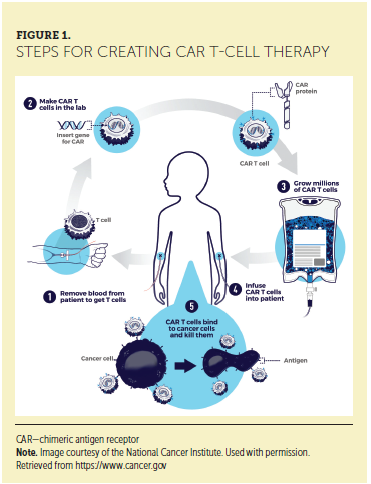
Η παραγωγή αυτόλογων CAR Τ κυττάρων είναι μια προσεκτικά καθορισμένη και ρυθμιζόμενη διαδικασία. Η διαδικασία για τη θεραπεία ασθενών με αυτά τα προϊόντα είναι περίπλοκη και μπορεί να είναι χρονικά εντατική. Το πρώτο βήμα στη διαδικασία είναι η συλλογή Τ κυττάρων από τον ασθενή που πρόκειται να αντιμετωπιστεί. Αυτό επιτυγχάνεται μέσω της αφαίρεσης, κατά τη διάρκεια της οποίας το αίμα αφαιρείται από το σώμα και διαχωρίζεται με φυγοκέντρηση. Όλα τα συστατικά του αίματος, εκτός από την επιθυμητή – στην περίπτωση αυτή το λεύκωμα – επιστρέφουν στη συνέχεια στον ασθενή. Το λεύκωμα, συμπεριλαμβανομένων των επιθυμητών Τ κυττάρων, στη συνέχεια αποστέλλεται στη μονάδα επεξεργασίας. Κλινικές ανησυχίες για τον ασθενή κατά τη διάρκεια αυτού του σταδίου της διαδικασίας περιλαμβάνουν την πρόσβαση IV μεγάλης διαμέτρου, πόνο και διήθηση. Εάν η περιφερική πρόσβαση με μεγάλες οπές δεν αποτελεί επιλογή, απαιτείται κεντρικός φλεβικός καθετήρας και μπορεί να προτιμάται με βάση την θεσμική πολιτική. Στο εργαστήριο, τα Τ κύτταρα από το προϊόν του ασθενούς απομονώνονται. Αυτά τα κύτταρα επιλέγονται μέσω έκθεσης σε επικαλυμμένα με αντι-CD3 / CD28 σφαιρίδια που ενεργοποιούν ex νίνο ενεργοποίηση Τ-κυττάρων. Διάφορες επιλογές επιλογής είναι διαθέσιμες, συμπεριλαμβανομένων των υπερπαραμαγνητικών σφαιριδίων και των βιοαποικοδομήσιμων σφαιριδίων, τα οποία ζευγαρώνουν με αντισώματα CD3 και CD28, επιτρέποντας την επιλογή και την ενεργοποίηση των Τ κυττάρων. Το γονίδιο CAR προσαρτάται στη συνέχεια στα Τ κύτταρα του ασθενούς μέσω επώασης χρησιμοποιώντας έναν αδρανοποιημένο ιικό φορέα, ο οποίος εισέρχεται στο Τ κύτταρο και εισάγει το γενετικώς τροποποιημένο υλικό. Μετά τα CAR Τ κύτταρα πολλαπλασιάζονται in vitro για να δημιουργήσουν επαρκή αριθμό κυττάρων για αποτελεσματική θεραπεία. Ο όγκος των κυττάρων-στόχων είναι συγκεκριμένος για το προϊόν και μπορεί να περιλαμβάνει τη δοσολογία με βάση το βάρος του ασθενούς. Μετά τον πολλαπλασιασμό, τα σφαιρίδια αφαιρούνται και το προϊόν κρυοσυντηρείται πριν μεταφερθεί πίσω στη μονάδα επεξεργασίας. Αυτή η διαδικασία, από τη συλλογή του αυτόλογου προϊόντος στην επιστροφή του προϊόντος CAR Τ κυττάρων, διαρκεί τουλάχιστον δύο εβδομάδες και εξαρτάται από την ταχύτητα της κυτταρικής αναπαραγωγής για να παραχθεί ο ελλειμματικός στον αναδιπλασιασμό ιϊκός φορέας.
Επειδή η υποκείμενη ασθένεια και η προηγούμενη θεραπεία μπορεί να επηρεάσουν την ποιότητα των συλλεχθέντων λεμφοκυττάρων, ακολουθούνται καθορισμένες παράμετροι για λευκαφαίρεση. Η λευκαφαίρεση πρέπει να πραγματοποιείται τουλάχιστον τρεις μήνες μετά την προηγούμενη μεταμόσχευση βλαστοκυττάρων, με συνιστώμενη έγχυση του tisagenlecleucel τουλάχιστον έξι μήνες μετά τη μεταμόσχευση, λόγω του κινδύνου για αλλοαντιδραστικά λεμφοκύτταρα. Αυτή η απουσία θεραπείας, σε συνδυασμό με τον χρόνο που απαιτείται για την παρασκευή του προϊόντος, μπορεί να απαιτήσει τη θεραπεία γέφυρας για τη νόσο του ασθενούς μεταξύ της συλλογής και της έγχυσης CAR Τ-κυττάρων λόγω της επιθετικής φύσης της υποκείμενης κακοήθειας. Τα στεροειδή ενδέχεται επίσης να πρέπει να περιοριστούν κατά τη διάρκεια αυτής της περιόδου λόγω ανησυχίας για τις λεμφυτικές ιδιότητές τους, ιδιαίτερα την καταστολή των Τ-κυττάρων.
Πριν από την έγχυση του προϊόντος CAR Τ-κυττάρου, ο ασθενής λαμβάνει λεμφο -εξαντλητική χημειοθεραπεία. Τα αποτελέσματα της μελέτης συνιστούν συνδυασμό κυκλοφωσφαμίδης και φλουδαραβίνης. Το σχήμα σχεδιάζεται για την εξάντληση ρυθμιστικών Τ -κυττάρων προς όφελος της επέκτασης του προϊόντος CAR- Τ κυττάρων. Το κυτταρικό προϊόν εγχύεται περίπου δύο ημέρες μετά την ολοκλήρωση της χημειοθεραπείας. Οι ασθενείς προετοιμάζονται σύμφωνα με τις θεσμικές παραμέτρους ή τις παραμέτρους πρωτοκόλλου, συνήθως με ακεταμινοφαίνη και διφαινυδραμίνη, για να μειωθεί ο κίνδυνος αντίδρασης στο προϊόν. Η έγχυση του προϊόντος πρέπει να πραγματοποιηθεί εντός 30 λεπτών από την απόψυξη. Μόλις εγχυθούν, τα CAR- T κύτταρα, αυτά συνεχίζουν να πολλαπλασιάζονται, φθάνοντας στην μέγιστη διόγκωση τους εντός δύο εβδομάδων μετά την έγχυση, με απόδειξη συνεχούς πολλαπλασιασμού σε ένα έτος ή και περισσότερο. Αυτή η ανοσοποιητική εμμονή έχει συσχετιστεί με ανθεκτική πλήρη ύφεση, επιτρέποντας τη συνεχή ανοσολογική παρακολούθηση από τα ενεργοποιημένα Τ -κύτταρα για την προώθηση της εξάλειψης της τρέχουσας και ενδεχομένως μελλοντικής κακοήθειας.
Νέες ενδείξεις
Οι πρώτες επιτυχίες των CAR- Τ κυττάρων σε ALL και DLBCL παρείχαν ένα μονοπάτι για την διερεύνηση άλλων αιματολογικών και μη αιματολογικών κακοηθών ενδείξεων. Με τον μηχανισμό δράσης της, η αποτελεσματικότητα και η χρησιμότητα ενός CAR -Τ κυττάρου εξαρτάται από την ταυτοποίηση μιας επιφανειακής πρωτεΐνης στόχου στην οποία μπορεί να κατευθύνεται. Αν και οι πρώτες δοκιμές CAR -T κυττάρων έχουν κατευθυνθεί στις πρωτεΐνες CD19 και CD22 στην επιφάνεια των Β-κυττάρων που είναι γνωστό ότι είναι υπεύθυνες για την ALL και το DLBCL των Β-κυττάρων, αξιολογούνται νέες πρωτεΐνες στόχοι. Μέχρι σήμερα, διεξάγονται περισσότερες από 180 κλινικές δοκιμές, οι οποίες στοχεύουν στις πρωτεΐνες (CD19 και 22 ή CD19 και 123) οι οποίες είναι γνωστό ότι είναι υπερεκφρασμένες πρωτεΐνες στην επιφάνεια των Β κυττάρων που ευθύνονται για λευχαιμίες και λεμφώματα (Leukemia and Lymphoma Society, 2018).
Από τις αιματολογικές κακοήθεις ενδείξεις που εξετάζονται επί του παρόντος, το ανθεκτικό ή υποτροπιάζον πολλαπλό μυέλωμα κατέχει τη μεγαλύτερη υπόσχεση. Οι κλινικές δοκιμές σε μεταγενέστερο στάδιο που αξιολογούν τη χρήση CARs που κατευθύνονται στην πρωτεΐνη αντιγόνου ωρίμανσης Β-κυττάρων, η οποία βρίσκεται στην επιφάνεια των κυττάρων πολλαπλού μυελώματος, κατέδειξαν αποτελεσματικότητα στην επίτευξη ανθεκτικών αποκρίσεων με ένα προφίλ τοξικότητας όπως αυτές που εντοπίστηκαν σε ενδείξεις λευχαιμίας και λεμφώματος.
Οι συμπαγείς όγκοι παρουσιάζουν μια πιο περίπλοκη σειρά επιφανειακών πρωτεϊνών, γεγονός που καθιστά την εύρεση ενός κοινού στόχου για τα CARs πιο δύσκολο. Μία κοινή πρωτεΐνη κυτταρικής επιφάνειας που βρίσκεται σε όγκους παγκρεατικού, πνεύμονα, ωοθηκών και μεσοθηλιώματος είναι η μεσοθηλίνη. Οι κλινικές δοκιμές σε πρώιμη φάση αξιολογούν τα CAR T κύτταρα που κατευθύνονται σε μεσοθηλίνη σε αυτή την ομάδα ασθενών και έχουν επιδείξει κάποια πρώιμη αποτελεσματικότητα και ένα αποδεκτό προφίλ ασφάλειας. Μεγαλύτερες κλινικές μελέτες για τις ενδείξεις αυτές βρίσκονται σε εξέλιξη. Το 2019, χορηγήθηκε χρηματοδότηση από το Εθνικό Ινστιτούτο Καρκίνου για να διερευνηθεί ευρέως η εφαρμογή της θεραπείας με CAR Τ-κύτταρα σε κακοήθειες συμπαγούς όγκου, συγκεκριμένα τον καρκίνο του πνεύμονα και το μεσοθηλίωμα.
Άλλες ενδείξεις συμπαγούς όγκου που υπάρχουν σήμερα σε κλινικές δοκιμές περιλαμβάνουν νευροβλάστωμα, γλοιοβλάστωμα, γλοιώματα και ηπατοκυτταρικά καρκινώματα. Αυτοί οι όγκοι έχουν εντοπίσει στοχευόμενα αντιγόνα ή πρωτεϊνική έκφραση, όπως EGFRvIII, GD2 ή γλυπικάνη-3, που μπορεί να κατευθύνεται με CAR. Πρόσθετες μελέτες αξιολογούν τη μεθοδολογία χορήγησης της θεραπείας με CAR T κύτταρα αν και τα περισσότερα προϊόντα έγχυσης Τ-κυττάρων CAR χορηγούνται μέσω IV, οι μελέτες συνεχίζουν να αξιολογούν την ενδοκοιλιακή χορήγηση για ενδείξεις όγκου στον εγκέφαλο και άμεση χορήγηση στη θέση του όγκου, όπως για τους ηπατοκυτταρικούς όγκους.
Ένα από τα βασικά οφέλη της θεραπείας με CAR-T κύτταρα είναι η χρήση ενός αυτόλογου προϊόντος για τον ασθενή, εξαλείφοντας το ενδεχόμενο εμφάνισης ασθένειας μοσχεύματος έναντι ξενιστή με αλλογενείς εγχύσεις. Ωστόσο, αυτή η διαδικασία είναι μακρά και περιλαμβάνει πολλαπλά στάδια συλλογής και παραγωγής. Για να γίνει πιο εύκολη η επεξεργασία με μεγαλύτερη αποτελεσματικότητα στην παραγωγή, διερευνώνται εναλλακτικές μέθοδοι. Πολυάριθμα εργαστήρια ακαδημαϊκών και βιοτεχνολογιών διερευνούν την ανάπτυξη ενός προϊόντος CAR T-κυττάρων «off-the-shelf». Αυτή η μέθοδος περιλαμβάνει τη δημιουργία μίας τράπεζας κύριων κυττάρων προερχόμενης από επαγόμενα πολυδύναμα βλαστοκύτταρα που αναπτύσσονται από κύτταρα δότες. Χρησιμοποιώντας τεχνικές επεξεργασίας γονιδίων, αυτά τα κύτταρα αίματος επαναπρογραμματίζονται για να γίνουν ανώριμα (αδιαφοροποίητα) βλαστοκύτταρα που παρέχουν μια κενή πλάκα για τη δημιουργία μιας γραμμής ανοσοκυττάρων που μπορεί να επεκταθεί και να αναπαραχθεί εύκολα. Για να αποφευχθεί η ανοσοαπόκριση που θα αναμενόταν με τη χρήση κυττάρων-δοτών, ο υποδοχέας των Τ-κυττάρων απομακρύνεται κατά τη διάρκεια της διαδικασίας επεξεργασίας των γονιδίων, καθιστώντας αυτά τα κύτταρα ανίκανα να προσβάλλουν τα Τ-κύτταρα του λήπτη. Αυτή η διαδικασία καθιστά δυνατή την καθολική χρήση των νέων κυττάρων. Αυτά τα νέα Τ-λεμφοκύτταρα μπορούν να μετατραπούν για να εισαγάγουν το επιθυμητό CAR για την προτεινόμενη ένδειξη ή στόχο της νόσου και κατόπιν να κρυοσυντηρηθούν και να αποθηκευτούν για εύκολη πρόσβαση για τους ασθενείς.
Παρόλο που η μεθοδολογία δημιουργίας αυτών των προϊόντων CAR- T κυττάρων «off-the-shelf» έχει αποδείξει τη σκοπιμότητα της, εξακολουθεί να διερευνάται η ασφάλεια, η αποτελεσματικότητα και η συγκρισιμότητα με τα υπάρχοντα αυτόλογα προϊόντα CAR -Τ κυττάρων. Μέχρι σήμερα, οι δοκιμές που αξιολογούν αυτές τις νέες μεθόδους βρίσκονται ακόμη σε πρώιμες φάσεις κλινικής ανάπτυξης.
Ο ρόλος της ογκολογικής νοσηλευτικής
Καθώς οι εγκρίσεις θεραπείας CAR- Τ κυττάρων επεκτείνουν παράγοντες και ενδείξεις, καθώς και εφαρμογές πρώτης γραμμής θεραπείας για πρόοδο της νόσου, οι νοσηλευτές αναμένεται να παρέχουν ασφαλή και αποτελεσματική φροντίδα των ασθενών. Η ασφαλής νοσηλευτική πρακτική βασίζεται στη συνεχή εκπαίδευση σχετικά με αυτές τις εξελίξεις στην περίθαλψη. Η εξοικείωση με τη γλώσσα της θεραπείας CAR Τ-κυττάρων, συμπεριλαμβανομένων των κοινών όρων που σχετίζονται με τη θεραπεία, είναι σημαντική. Παρόλο που η χορήγηση των CAR -Τ κυττάρων περιορίζεται επί του παρόντος σε επιλεγμένα κέντρα σε όλες τις Ηνωμένες Πολιτείες, οι ασθενείς επιστρέφουν στην πρωτοβάθμια ογκολογική και κοινοτική φροντίδα για παρακολούθηση ή αντιμετώπιση άλλων οξέων και χρόνιων ασθενειών. Αυτό απαιτεί την εκπαίδευση των νοσηλευτών που εργάζονται σε ογκολογικές και μη ογκολογικές περιστάσεις, συμπεριλαμβανομένων των κέντρων έκτακτης ανάγκης, για να εξασφαλίσουν την προετοιμασία για τη φροντίδα αυτών των ατόμων. Οι νοσηλευτές στη ρύθμιση της αφαίρεσης είναι θεμελιώδεις για την ασφαλή και αποτελεσματική συλλογή των θετικών κυττάρων CD3 και πρέπει συνεπώς να συμπεριληφθούν στην ολοκληρωμένη εκπαίδευση σχετικά με τη διαδικασία συλλογής CAR -Τ κυττάρων. Για όσους διαχειρίζονται το φάρμακο ή διαχειρίζονται ασθενείς κατά τη διάρκεια και αμέσως μετά τη χορήγηση, ο FDA απαιτεί εκπαίδευση για την αξιολόγηση του κινδύνου και τη στρατηγική μετριασμού (REMS) για κάθε εγκεκριμένο φάρμακο. Οι γνώσεις των νοσηλευτών μπορούν να μεταφραστούν σε βελτιωμένη εκπαίδευση για τους ασθενείς και τους φροντιστές τους σχετικά με το τι πρέπει να αναμένουν σε όλη τη διαδικασία θεραπείας CAR -Τ κυττάρων.
Η θεραπεία με CAR- Τ κύτταρα είναι εγκεκριμένη θεραπεία και η φροντίδα των ασθενών προσαρμόζεται στις μοναδικές φυσιολογικές και ψυχοκοινωνικές ανάγκες των ασθενών σε όλα τα αναπτυξιακά στάδια. Η φροντίδα του παιδιού που νοσεί με καρκίνο απαιτεί διαφορετικές προσεγγίσεις και εντατική φροντίδα, για να διασφαλιστεί ότι ικανοποιούνται οι ανάγκες του ασθενούς και της οικογένειας του. Η καθιέρωση καθορισμένων κατευθυντήριων γραμμών, τυποποιημένων διαδικασιών λειτουργίας και σχεδίων περίθαλψης μπορεί επίσης να βοηθήσει στην υποστήριξη των μεταβάσεων σε όλα τα στάδια της θεραπείας CAR -Τ κυττάρων από συλλογή κυττάρων, μέσω κλινικής χημειοθεραπείας και έγχυσης μέχρι την τελική επιβίωση. Η διαχείριση της τοξικότητας αποτελεί επίσης σημαντικό στοιχείο της διαχείρισης της περίθαλψης.
Τελικά;
Η αποτελεσματικότητα της θεραπείας με CAR- Τ κυττάρων κερδίζει έδαφος. Τα προϊόντα αυτά χαρακτηρίζονται ως ζωντανά φάρμακα λόγω των εγγενών μηχανισμών τους με την ικανότητα μακροχρόνιας επιμονής της θεραπείας. Ωστόσο, οι ίδιοι μηχανισμοί ενεργοποίησης, επέκτασης και εμμονής πιστεύεται ότι είναι υπεύθυνοι για τις δυνητικά σοβαρές επιπλοκές του συνδρόμου απελευθέρωσης κυτοκίνης και της νευρολογικής τοξικότητας που συχνά συνδέεται με αυτές τις θεραπείες. Νέες και βελτιωμένες τεχνικές διαχείρισης για αυτές τις τοξικότητες λαμβάνουν μεγάλη προσοχή στη βιβλιογραφία καθώς η χρήση της θεραπείας CAR -Τ κυττάρων επεκτείνεται. Οι νοσηλευτές αποτελούν αναπόσπαστο μέρος της ασφαλούς και αποτελεσματικής φροντίδας αυτών των ασθενών και μπορούν να υποστηρίξουν τις βέλτιστες πρακτικές μέσω της συνεχιζόμενης εκπαίδευσης καθώς αυτές οι θεραπείες εξελίσσονται.